الألمنيوم AluminiumAluminium
Al
العدد الذري : 13
الكتلة الذرية : 26.981539
درجة الإنصهار : 660.37 درجة مئوية
درجة الغليان : 2467.0درجة مئوية
الكثافه : 2.702 جم/سم3
عدد الأكسدة : 3
التوزيع الألكتروني : Ne]3s2.3p1 ]
تاريخ الألمنيوم ووجودة في الطبيعة اصل التسمية ترجع الى الكلمة اليونانية alumen . وقد اكتشف الألمنيوم عام 1825م بواسطة العالم هانز كريستيم اورستيد وظل حتى نهاية القرن التاسع عشر شيئاً غريباً غالياً , يستخدم لصناعة الحلي . بالرغم من انه اكثر الفلزات وثالث العناصر شيوعاً في القشرة الأرضية بعد الأكسجين والسيليكون إذ يدخل في تكوين معظم انواع الصخور والطمي .
ويوجد في الطبيعة على عدة اشكال اهمها سيليكات الألمنيوم Al2 (SiO3)3 والبوكسايتAl2O3.XH2O والكريوليت Na3AlF6 .
لم يبدأ استخدام الألمنيوم على نطاق واسع الابعد مطلع القرن العشرين بعد ان تبين ان سبائكة مع فلزات اخرى لها نفس قوة الصلب بثلث الوزن تقريباً, واصبح الألمنيوم يحتل المركز الثاني في الإستخدامات بين الفلزات بعد الحديد واهم الخصائص التي اوصلتة الى هذا المركز هي خفة وزنة , فوزنه النوعي 2.75(الوزن النوعي للحديد يتراوح بين 7,3الى 7,9 والنحاس 8,95 ) .
استخلاص الألمنيوم
كان الألمنيوم حتى عام 1866يحضر باختزال الاوكسيد بالصوديوم .
x 6Na Al2 O3 --------> 2Al 3Na2O
ونظراً لارتفاع تكاليف الصوديوم وخطورة استخدامة , كان لابد من ايجاد طريقة اقل تكلفة واقل خطراً .
ففي عام 1886توصل كلاً من بول هيرولت وشارل هول "دون اتصال بينهما" الى استخلاص الألمنيوم بالتحليل الكهربي للبوكسايت Al2O3 النقي في مصهور الكريوليت Na3AlF6 عند درجة 1000درجة مئوية .
حيث يستخدم وعاء من حديد الصلب مبطن بالجرافيت قطباً سالباً ,بينما يكون القطب الموجب من قضبان كبيرة من الجرافيت تتدلى داخل مصهور Al2O3 _ Na3AlF6) ( ويتكون الألمنيوم النقي على القطب السالب ويهبط الى القعر ويسحب من مخرج خاص .
x 2Al2 O3 -----------> 4Al 3O2
اهم تفاعلات الألمنيوم1- يحترق الألمنيوم إذا سخن في الهواء خاصة إذا كان مسحوقاً , وقد وجد ان مخلوطاً من دقائق الألمنيوم والهواء قابل للانفجار . واحد اسباب ذلك ان تفاعلة مع الأكسجين يولد كمية كبيرة من الحرارة :نظراً لكثافتة القليلة ومتانتة فإنة يستخدم في الأغراض التي تتطلب متانة وخفة في الوقت نفسة كصناعة الطائرات واستكمال بناء السفن,ونوافذ وابواب المساكن .
حرارة x2Al 3 O2 -----> 2Al2O3
2- يتفاعل مع الهالوجينات :
x 2Al 3X2 -------> 2AlX3
3- يتفاعل مع حامض الهيدروكلوريك :
x 2Al 6HCl ------> 2AlCl3 3H2
4- يتفاعل مع محلول هيدروكسيد الصوديوم المائي :
x 2Al 6NaOH --------> x 2Na3AlO3 3H2
خواصة
يعتبر من اوفر الفلزات في القشرة الأرضية ولا يفوقة من العناصر الإ السيليكون والأكسجين .
لايوجد الألمنيوم بشكل حر وإنما على هيئة مركبات .
الالمنيوم فلز فضي اللون ,لين نوعاً ما , لكنة يكتسب صلابة بسبكة مع معادن اخرى كالمغنيسيوم, يمتاز بالمتانة والخفة .
- كثافتة منخفضة .
- قابل للطرق والسحب .
- موصل جيد للحرارة والكهرباء .
- عنصر نشط .
- لايتآكل في الجو بسبب تكون طبقة واقية من اكسيدة عند تعرضة للجو .
- عنصر متردد لتفاعلة مع الاحماض والقواعد
بعض استخداماتة
بسبب جودة توصيلة للكهرباء والحرارة فإنة يستخدم في عمل الأسلاك الكهربية , وادوات الطبخ .
يستخدم الألمنيوم المسحوق في تحضير الدهانات .
يستخدم كرقائق لحفظ الاطعمة .
يستخدم في صناعة علب المشروبات .
حديثاً لعب الألمنيوم دوراً هاماً في ترميم المباني التاريخية .
يستخدم في تصنيع القطع الألكترونية الخاصة بأجهزة الحاسب الالي .
ذرة الألمنيوم
تتميز ذرة الألمنيوم باحتوائها في حالتها الأساسية على طبقة إلكترونية سطحية تحتوي على ثلاثة إلكترونات، وبذلك يكون تشكيله الإلكتروني في حالته الأساسية 1S 2, 2S 2, 2P 6, 3S 4, 2P 1 . وتوضح كمونات تشرد (تأين) إلكتروناته السطحية الأولـى (مقدرة بالإلكترون فلط) أنها أسهل نزعاً من الإلكترونات الأخرى: فالتشرد الأول 5.95، والتشرد الثاني 18.82، والتشرد الثالث 28.44، والتشرد الرابع 120.000.
وتعلِّل السهولة النسبية التي يمكن بها نزع الإلكترونات الثلاثة الخارجية: Al Š Al ++++ 3e - الصفة الكهرجابية (الكهربائية الإيجابية) الشديدة للألمنيوم وانخفاضَ قيمة كمون الأكسدة والإرجاع العائد له (-1.67فلط ) .
معدن الألمنيوم
الألمنيوم جسم صلب بلوري ذو لون أبيض فضي؛ تبلغ قوة شده عندما يكون مليّناً بالتحمية 463كغ/سم 2، وعندما يكون مصفحاً بالبارد 1089كغ/سم.2 وهو غير سام وخفيف جداً، كثافته النسبية 2.708، ينصهر في الدرجة 660ْس، ويغلي في الدرجة 2450ْس، وهو معدن لين وكبير الاستطالة، ويمكن أن يستطيل بالشد إلـى مدى50% من طوله. وهو ناقل جيد للحرارة والكهرباء إذ تبلغ ناقليته ثلثي ناقلية النحاس، وهو عاكس ممتاز للأشعة فوق البنفسجية والمرئية وتحت الحمراء، ويمكن أن تصل درجة عكسه للأشعة تحت الحمراء إلـى 97%. يتكون على سطحه في حالته الطبيعة غشاء حافظ من أكسيد الألمنيوم Al2O3 يبلغ ثخنه 50 أنغستروماً ( A ْ= 10 -10 متر) يقيه من الائتكال العادي.
مراحل تاريخ الألمنيوم وسبائكه ـ الخليطة
حضَّر العالم الإنكليزي همفري ديفي Humphry Davy الألمنيوم المشوب عام 1808 واكتشف الفرنسي بيير برتْيه (1782-1861) Pierre Berthier فلزاً يحتوي على نسبة كبيرة من أكسيد الألمنيوم في منطقة «لي بو» Les Baux عام 1821 وأطلق عليه اسم بوكسيت نسبة إلى المنشأ. وفي عام 1825 عزل الدنمركي كريستيان أورستد Christian Oersted الألمنيوم على هيئة مسحوق. وفي عام 1827 حصل فريدريك فوهلر (1800 -1882) Friedrich Wohler على مسحوق الألمنيوم بإرجاع كلوريد الألمنيوم بالبوتاسيوم. وفي عام 1854 حسَّن الفرنسي هنري سانت ـ كليردوفيل Henri Saint-Claire Deville طريقة فوهلر مستعملاً الصوديوم عامل إرجاع، وقدَّم بذلك طريقة جديدة تُطبق عملياً على النطاق الصناعي وذلك بالتحليل الكهربائي لمضاعف كلوريد الألمنيوم والصوديوم المصهور.
وفي عام 1859 حصل سانت كليردوفيل على الألُمين من البوكسيت وكربونات الصوديوم، وأرجع الألُمين بالصوديوم للحصول على الألمنيوم. وفي عام 1861 اقترح الفرنسيان لوي لوشاتوليه Louis Le Chatelier وسانت كليردوفيل تحليلاً كهربائياً للكريوليت Na 3AlF 6 المصهور مع كلوريد الصوديوم.
وفي عام 1886 تقدم الفرنسي بول هيرو (1863- 1914) Paul Héroult بطلب ليسجل في فرنسة براءة بطريقة التحليل الكهربائي electrolysis للألُمين المصهور في الكريوليت المصهور بمصعد من الكربون، وذلك في الوقت نفسه الذي حصل فيه الأمريكي تشارلز مارتن هول (1863- 1914) Charles Martin Hall في الولايات المتحدة على براءة بطريقة صنع الألمنيوم بالتحليل الكهربائي للألُمين المصهور في حمام من فلوريدات الألمنيوم والمعادن القلوية. وفي عام 1890 تقدم النمسوي كارل جوزيف باير Karl Joseph Bayer بطريقة جديدة للحصول على الألُمين الصرف.
إعداد الألمنيوم
يتم الحصول على الألمنيوم من البوكسيت، وهو أكسيد ألمنيوم مميَّه. يتكون البوكسيت من الألُمين (50- 60%) Al 2O 3 والسيليس (3- 5%) وأكسيد التِتان (2- 4%) وأكسيد الحديد (20-30%). ويصعب في حالة الألمنيوم تطبيق الطرائق التقليدية المتبعة في استحصال المعادن، إذ يتم فيها تحضير المعدن (أو محلول له) مشوباً في بادئ الأمر ثم ينقّى من شوائبه، ذلك لأن الألمنيوم شديد القابلية للتأكسد. لذا تعتمد طرائق تحضيره على استحصال الألُمين بدرجة نقاوة عالية ثم تحليله كهربائياً.
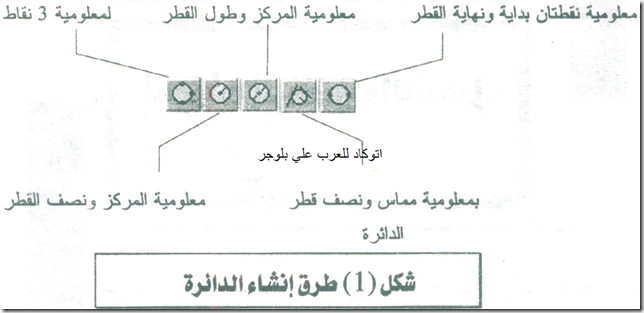
ولتنقية الألُمين وفق طريقة باير الأكثر شيوعاً (الشكل 1) يُعالَج خام البوكسيت تحت ضغط مرتفع بمحلول الصود الكاوي (هدروكسيد الصوديوم) المركّز الساخن فيذوب السيليس متحولاً إلى سيليكات، ويذوب أكسيد التِتان متحولاً إلى التيتانات، وتذوب أكاسيد الألمنيوم متحولة إلى ألومينات Na 3AlO 3 أو NaAlO 2 .
Al 2O 3+6NaOH Š 2Na 3AlO 3+3H 2O
وأما أكسيد الحديد Fe 2O 3 فيترسب على شكل وحل أحمر.
يُفصل محلول ألومينات الصوديوم من الرواسب بالمرشِّح الضاغط ويرسَّب الألُمين من الرشاحة بالتبريد والتخفيف بالماء وإمرار غاز ثاني أكسيد الكربون الذي يتفاعل مع هدروكسيد الألمنيوم ويعجِّل بذلك في انفصال هدروكسيد الألمنيوم:
Na 3AlO 3+3H 2O Š Al(OH) 3+3NaOH
يُفصل هدروكسيد الألمنيوم من المحلول بالترشيح ويتم غسله جيداً بالماء ثم يكلَّس في أفران دوّارة تبلغ درجة الحرارة فيها نحو 1000ْ س للحصول على الألُمين الجاف:
2Al(OH) 3 D Al 2O 3+3H 2O
يُشحن الألُمين اللامائي الناتج إلى وحدات المعالجة بطريقة هول ـ هيرو (الشكل 1) حيث يُرجع بالتحليل الكهربائي في خلية (حمام) نموذجية تتألف من حوض فولاذي مستطيل مبطن بالآجر العازل والكربون يحوي متحللاً بالكهرباء (إلكتروليت) مؤلفاً من الألُمين والكريوليت المنصهر (الكريوليت ملح مضاعف لفلوريد الألمنيوم وفلوريد الصوديوم بنسبة جزيء من الأول إلى ثلاثة جزيئات من الثاني 3NaF, AlF 3 ). ويغطي القعر الكربوني مَفْرش من الألمنيوم المصهور يعمل مهبطاً. وتعلق في المتحلل الكهربائي كتل من الكربون سبق تحميصها، ويُستخدم الكربون مصعداً لأنه لم تعرف حتى الآن مادة بديلة تقاوم المفعول الإئتكالي لمصهور الفلوريد ولأنه مرجِع متحلل بالكهرباء(كهرليتي) مناسب للألُمين. ويمر التيار المهبطي بالقعر الكربوني عن طريق قضبان فولاذية متصلة بالمهبط.
إن آلية التفاعلات التي تحدث داخل الخلية غير معروفة على وجه الدقة، وأبسط النظريات تفترض تأين (تشرد) الألُمين في درجات الحرارة العالية. وفي أثناء التحليل الكهربائي يتوضع الألمنيوم على المفرش المعدني أي المهبط، ويتحرر الأكسجين عند المصعد ليتفاعل مع الكربون معطياً ثنائي أكسيد الكربون CO 2 ، كما يُرجع الكربون قسماً من CO 2 إلى أحادي أكسيد الكربون CO بتفاعلات ثانوية. وبعد فواصل زمنية تراوح بين 24 و48 ساعة يُترك مصهور الألمنيوم يسيل من مثْعب (سيفون) siphon من أنبوب بشكل W متصل بالخلية.
يتطلب إجراء هول مقادير كبيرة من الطاقة الكهربائية (نحو 14000 كيلو واط/ساعة لاستحصال الطن الواحد) وتعتريه مشكلة التلوث بالفلوريد السام.
وهناك طرائق حديثة لتحضير الألمنيوم منها:
ـ طريقة «شركة ألمنيوم أمريكة» Aluminium Company of America : وهي طريقة أكثر فعالية لإنتاج الألمنيوم من البوكسيت، وفيها يتفاعل أكسيد الألمنيوم مع الكلور معطياً كلوريد الألمنيوم، وبالتحليل الكهربائي لهذا الأخير ينتج المعدنُ والكلور. وتمتاز خطة هذه الشركة بعدم استعمال الفلوريد وباستهلاك ثلث ما تتطلبه طريقة هول ـ هيرو من طاقة كهربائية.
ـ طريقة توث Toth : يُنتج معدن الألمنيوم في هذه الطريقة من الكاؤلان kaolin وضروب أخرى من الغضار الغني بأكسيد الألمنيوم، وفيه يكلَّس الغضار ويكلْوَر ثم يُفاعل كلوريد الألمنيوم الناتج بالمنغنيز المعدني فيعطي الألمنيوم وكلوريد المنغنيز. يحدث التفاعل في درجة حرارة منخفضة نسبياً (260ْ س) ويستعاد معدن المنغنيز وغاز الكلور من كلوريد المنغنيز بالتحليل الكهربائي لمصهوره، ويعاد استعمالهما في العملية.
تعد طريقة توث أكثر فعالية وأقل كلفة من طريقة هول، فهي أقل استهلاكاً للطاقة ولا يستعمل فيها البوكسيت المستورد.
ـ الطريقة اللاكهربائية: وهي طريقة لا تستعمل فيها الكهرباء، بل يسخن مزيج خامات الألمنيوم مع وقود مشتق من الفحم الحجري في فرن مغلق، فتنتج سبائك خليطة من الألمنيوم والسيليسيوم Al-Si يمكن تنقيتها إلى الألمنيوم الصرف.
ومن طرائق التنقية للحصول على الألمنيوم الفائق النقاوة طريقة المحص بالمناطق zone refining التي تشتمل على انصهار وتبلور متكررين، وذلك بوضع العينة المراد تنقيتها في أنبوب ضيق طويل نسبياً وتمرر ببطء عبر فرن ذي مناطق قصيرة حارة وباردة بالتناوب، فيحدث الانصهار في المناطق الحارة ويحدث التبلور في المناطق الباردة. فعندما ينتقل القضيب عبر الفرن يمر تباعاً بجميع المناطق فتبقى الشوائب في المناطق المصهورة منتقلة إلى نهاية واحدة من القضيب.
وكثيراً ما يلجأ إلى هذه الطريقة للحصول على مواد نقية جداً وذلك عندما تكون الكميات صغيرة ومرتفعة التكاليف، إذ يمكن أن تبلغ من النقاء درجة لا يبقى فيها من الشوائب إلا 2،0 جزء بالمليون.
خواص الألمنيوم الكيمياوية
الألمنيوم معدن شديد الفعالية يتحد بالحرارة مع الهالوجينات والأكسجين والآزوت والكربون. ويطلق باحتراقه في الأكسجين كمية كبيرة من الحرارة وفق التفاعل:
2Al+3/2O 2 " Al 2O 3
ويُرجع الكثير من الأكاسيد محرراً المعدن الآخر، وتسمى هذه الطريقة الإرجاع الحراري بالألمنيوم:
2Al+Fe 2O 3 " Al 2O 3+2Fe
تؤثر في الألمنيوم محاليل كلور الماء المركّزة والممدّة، ويؤثر فيه حمض الكبريت المركّز وحمض فوق الكلور الساخنان، ولا يتأثر بحمض الكبريت الممدد أو المركّز الباردين، ولا بحمض الآزوت المركّز. تؤثر فيه القلويات القوية بعنف ويتشكل ملح الألومينات. ويتأكسد بسرعة بالماء بدرجة 180ْس. وهو غير قابل للاشتعال إلا عندما يكون مسحوقاً.
خلائط الألمنيوم
هي سبائك ـ خلائط alloys تحتوي على معادن كالنحاس والسيليسيوم والمغنزيوم والزنك، وتوجد منها ضروب كثيرة جداً تستعمل في سبك المقولبات وتشكيل المنتجات باللحم والطرق والتصفيح والسحب، ويمكن معالجة بعضها حرارياَ ولاسيما تقسيتها وتعتيقها. فالألمنيوم القاسي duralumin خليطة خفيفة عالية المقاومة. وهي تتألف من 95% من الألمنيوم و4% من النحاس و0.5% من المنغنيز 0.5% من السيليسيوم، وهي تقاوم الائتكال بالحموض وبماء البحر، وقابلة للطرق وتكتسب بعد التقسية مميزات ميكانيكية مهمة، وتستعمل قطعاً للطائرات وعربات السكك الحديدية والسفن والآلات المختلفة.
وتحتوي السبائك «ألمنيوم ـ مغنزيوم» 4- 8% من المغنزيوم و0.5- 1% من المنغنيز (ومنها الألوماغ alumag والدورالينوكس duralinox والمغناليوم magnalium )، وهي تستعمل، لمقاومتها الائتكال بالماء والمنتجات القلوية، في صنع السفن والحافلات وقوارير الغاز. وبإضافة 5- 9% من الزنك يُحصل على سبائك تُستعمل في صناعة الطائرات. فالسبيكة ـ الخليطة ذات 3% من المغنزيوم و0.3% من المنغنيز ذات قابلية جيدة للطَرق لذا تستعمل في صنع عناصر هياكل المركبات.
وتستعمل خلائط الألمنيوم ـ سيليسيوم في السبك لأن الخلائط التي تحتوي على 13% من السيليسيوم تكون مغايرة التحول eutectic ذات نقطة انصهار منخفضة وقابلية سيلان جيدة. وقد شاع استعمال الخلائط التي تحتوي على 10- 13% من السيليسيوم و1.5% من النحاس حداً أقصى و0.2- 1.5% من المغنزيوم و0.3% من المنغنيز «ألباكس» alpax في صنع السيارات (كتل المحركات، وظروف الأجهزة أو أحواضها، والمكابس) وفي صنع التجهيزات الكهربائية، وفي قولبة القطع سواء منها المعقدة الأشكال أو الضخمة.
أشكال الألمنيوم المتوافرة
تطرح في الأسواق أشكال بنيوية من الألمنيوم من جميع الأنماط: صفائح وقضبان وأسلاك ورقائق وقشور ومسحوق، ويمكن طلي الألمنيوم بالتحليل الكهربائي بطبقة من أكسيد الألمنيوم بالتصعيد anodizing في متحلل بالكهرباء ملائم كمحلول حمض الكروم أو حمض الكبريت للحصول على ما يدعى الألمنيوم المُصَعَد anodized aluminium .
وكثيراً ما يسبك الألمنيوم مع معادن أخرى أو يُقْرَن ميكانيكياً بألياف البور والسفير sapphire أو بشعيرات بلورية معدنية موجهة محورياً. وقد تم بذلك الحصول على متانات بلغت 3743 كغ/سم 2 في درجة 500ْس.
وتستعمل تقنية توضع البخار لتكوين غشاء من الألمنيوم على التيتانيوم والفولاذ يراوح ثخنه بين 5 و25 مكروناً.
أخطار الألمنيوم
يكوّن المسحوق الناعم للألمنيوم خلائط لهوبة ومنفجرة في الهواء، لذلك لا يسمح باحتواء الهواء على أكثر من 10مغ من المسحوق في المتر المكعب، كما لا يسمح باحتواء الهواء على أكثر من 2مغ من أملاح الألمنيوم الحلولة
استعمالات الألمنيوم
يستعمل الألمنيوم في البناء والإنشاء، وفي التجهيزات الكيمياوية المقاومة للائتكال (مصانع إزالة الملوحة)، وفي أجزاء السيارات المقولبة بالسبك، وفي الصناعة الكهربائية (خطوط نقل الطاقة)، وفي صنع ألواح الحفر الضوئي، والمغانط الدائمة، وفي التقانة القَرِّية cryogenic technology ، وفي صنع الآلات وتجهيزاتها الملحقة، وفي مختلف تجهيزات الإجرائيات الغذائية، وأنابيب المراهم ومعاجين الأسنان والحلاقة وغيرها. ويستعمل الألمنيوم مسحوقاً في الدهانات والأطلية، ووقوداً للصواريخ، وأحد مكونات المزائج الحارقة (الترميت thermite ) للحْم المعادن، ووسيطاً؛ وفي الخرسانة الرغوية، وممعدناً في الفراغ، وكساءً ورقائق في التغليف والطبخ والطبع الزخرفي؛ وقشوراً في عزل ضروب الوقود السائل.
أنظمة شحن مسحوق الألمنيوم
يجب أن تحمل عبوات مسحوق الألمنيوم عند شحنها في عربات السكك الحديدية والطائرات رقعاً كُتبت عليها عبارة «صلب لهوب » . ولا يسمح بشحن رغاء الألمنيوم في حال كونه ندياً أو ساخناً في عربات السكك الحديدية والطائرات.
مشتقات الألمنيوم الرئيسة
ومن هذه المشتقات ما يلي:
أكسيد الألمنيوم أو الألُمين: يوجد الألُمين متبلوراً في الطبيعة فيعرف باسم الياقوت أو القُرُنْد corundum ، ويتلون باللون الأحمر عندما يكون مشوباً بأكسيد الكروم فيسمى الياقوت الأحمر ruby ، وتلونه بعض خلائط الأكاسيد التي يدخل فيها التيتانيوم باللون الأزرق معطية السفير sapphire . كما يصنع من مسحوقه حجر الصَّنْفَرة الشديد الصلابة والمستعمل في السحج والتمليس ويكون مميهاً في البوكسيت.
يمكن تحضير أكسيد الألمنيوم مسحوقاً أبيض أو كرات أو كتلاً، وتتغير خواصه باختلاف طريقة تحضيره، فتراوح كثافته النسبية بين 3.4 و4، وينصهر في الدرجة 2030ْس، وهو عديم الانحلال في الماء، وضعيف الانحلال في الحموض المعدنية والقلويات القوية، وغير قابل للاحتراق وغير سام.
ويُحصل عليه بمعالجة البوكسيت بالصود الكاوي ثم يحلل الناتج تحليلاً مائياً فيترسب أكسيد الألمنيوم المميه أو هدرات الألُمين التي تعطي أكسيد الألمنيوم اللامائي بالترشيح فالتكليس المزيل للماء. كما يُحضر من مياه فضلات مناجم الفحم التي تعطي كبريتات الألمنيوم التي ترجع بعدئذ إلى الألُمين.
يطرح الألُمين في الأسواق على درجات مختلفة من النقاء، فمنه التقني، والنقي كيمياوياً، والألياف، والعالي النقاء، والمصهور، والمكلس، ويعبأ في أكياس من الورق متعددة الأغلفة، كما يعبأ في براميل.
ومن أخطاره سمية غباره بالاستنشاق، ويكون من الخطر استنشاق هواء يزيد فيه غبار أكسيد الألمنيوم على 10مغ/م 3.
وهو يستعمل في إنتاج الألمنيوم، وفي صنع أحجار السحج واللبنات المقاومة للحرارة والخزف والعوازل الكهربائية وحاملات الوسطاء والورق والجفنات والأدوات المخبرية، وفي امتزاز (تمزُّز) الغازات وبخار الماء، وفي التحليل الاستشرابي والمجوهرات الصنعية والألياف المقاومة للحرارة.
هدروكسيد الألمنيوم: هدروكسيد الألمنيوم Al 2O 3 ,3H 2O أو Al(OH) 3 مسحوق أبيض بلوري أو كرات أو حبيبات، كثافته النسبية 42،2، لا ينحل في الماء وينحل في الحموض المعدنية والصود الكاوي؛ وهو غير قابل للاشتعال.
يُحضر من البوكسيت بحل الخام في الصود الكاوي، ثم بتعديل محلول ألومينات الصوديوم الناتج فيترسب هدروكسيد الألمنيوم.
يُطرح هدروكسيد الألمنيوم في الأسواق على درجتين من النقاء: التقني والنقي كيمياوياً، وذلك في أكياس أو براميل أو من دون عبوات.
ويستعمل هدروكسيد الألمنيوم في صنع الزجاج والخزف والألمنيوم الخالي من الحديد، وأملاح الألمنيوم، وفي صنع الألُمين المنشط، وأساساً للكّات العضوية، ومؤخراً للهب؛ كما يستعمل مسحوقه الشديد النعومة (0.1-0.6 من المكرون) عاملَ تقوية للمطاط، وطلاءً للورق، ومالئاً، وفي مواد التجميل.
هلام هدروكسيد الألمنيوم: أو هلام الألُمين Al 2O 3,xH 2O وهو راسب هلامي أبيض تتغير ثوابته بتغير تركيبه؛ كثافته النسبية 2.4 تقريباً، لا ينحل في الحموض ولا في القلوي، وهو غير سام، وغير قابل للاشتعال.
يُحضر بمعالجة محلول كبريتات الألمنيوم أو كلوريد الألمنيوم بالصود الكاوي أو كربونات الصوديوم أو النشادر؛ ويرسب من محلول ألومينات الصوديوم بالتحميض بثنائي أكسيد الكربون عادةً أو بالبذر seeding .
يُطرح هلام الألُمين في الأسواق على درجات مختلفة من النقاء منها التقني والنقي كيمياوياً.
ويُستعمل مرسخاً في الصباغة، كما يستعمل في تنقية المياه، وفي صنع الأقمشة الكتيمة، وفي صنع اللّكات، ووسطاً مرشحاً، وفي صنع الكيمياويات (أملاح الألمنيوم)، وفي التراكيب المزلقة، وفي صناعة الزجاج، والورق اللاصق، وفي تلميع الخزف، ومضاداً للحموض.
شب البوتاس أو مضاعف كبريتات الألمنيوم والبوتاسيوم المتبلورة: صيغته Al 2(SO 4) 3,K 2SO 4, 24H 2O ويكتب AlK(SO 4) 2,12H 2O ، هو بلورات بيضاء عديمة الرائحة ذات طعم قابض، كثافته النسبية 1.75، ينصهر في الدرجة 92ْس، ويفقد في الدرجة 64.5ْس 18H 2O ، ويغدو لا مائياً في الدرجة 200ْس، وينحل في الماء ولا ينحل في الغول، ومحاليله المائية حمضية، وهو غير قابل للاشتعال وغير سام.
يُحضر شب البوتاس من الألونيت alunite أو اللوسيت leucite ، أو ببلورة محلول من كبريتات الألمنيوم وكبريتات البوتاسيوم.
ويُطرح في الأسواق على درجات مختلفة من النقاء منها التقني والمكتّل والمجروش والمسحوق.
ويستعمل مرسخاً في الصباغة، كما يستعمل في صنع الورق وعيدان الثقاب والدهانات، ووسيطاً في الدباغة، ووسيطاً لمنع نفوذ الماء، وفي تنقية المياه، وفي صنع أملاح الألمنيوم، ومضافاً غذائياً، ومسحوقاً للعجين (خميرة)، ومادة قابضة، ومقسياً إسمنتياً.
كلوريد الألمنيوم اللامائي: صيغته AlCl 3 ، هو بلورات بيضاء أو مصفرّة تنحل في الماء، كثافته النسبية 2.44 في الدرجة 25ْس. ينصهر في الدرجة 190ْس (في ضغط 5،2 ضغط جوي)، يتصعد بسهولة في الدرجة 178ْس، ويتألف بخاره من جزيئات مضاعفة Al 2Cl 6 .
يُحضر بتفاعل الكلور الغازي المنقى بمصهور الألمنيوم، أو بتفاعل البوكسيت مع فحم الكوك والكلور في الدرجة 875ْس تقريباً، ويشوبه كلوريد الحديد والألمنيوم الحر ومواد أخرى غير منحلة.
وهو سام إذا أُخذ عن طريق الفم أو جهاز التنفس، كما أنه مخرش شديد للأنسجة، ويتفاعل بعنف مع الماء مطلقاً غاز كلور الهدروجين HCl .
يستعمل وسيطاً في ألْكلة البنزن وكلوريد الإتيل والمواد الصيدلانية العضوية (وسيط فريدل ـ كرافتس) ومطاط البوتيل، وفي تكرير النفط، وفي تحضير راتنجات الفحوم الهدروجينية.
ويجب أن تحمل أوعيته عند شحنه في الجو رقعاً كتبت عليها كلمة «أكّال » .
هدرات كلوريد الألمنيوم: صيغته AlCl 3,6H 2O ، هو مسحوق بلوري متميع أبيض اللون أو أبيض مصفر، وهو عديم الرائحة تقريباً، وحلو الطعم، وطعمه قابض. كثافته النسبية 2.4، يتفكك بالتسخين، وينحل في الماء والغول.
يُحضر ببلورة الشكل اللامائي من محلوله في حمض كلور الماء.
ويطرح في الأسواق بأحد شكلين تقني ونقي كيمياوياً.
ويستعمل في صنع المواد الصيدلانية ومواد التجميل، والصبغات وحبيبات تغطية السقوف، والأوراق الخاصة والتصوير، والنسيج (الصوف).
سيليكات الألمنيوم: إن أياً من أنماط الغضار clay المتعددة التي تحتوي على نسب مختلفة من SiO 2,Al 2O 3 تحضَّر اصطناعياً بتسخين كلوريد الألمنيوم في الدرجة 1000-1200ْس مع السيليس وبخار الماء. تبلغ بلوراتها سنتمتراً واحداً طولاً، وهي ذات متانة عالية، وتستعمل في تقوية اللِدان، كما أن لسيليكات الألمنيوم استعمالات الطين نفسها.